Марганцевокислый калий
Содержание:
- Народные рецепты с марганцовкой: мифы и реальность
- Получение
- Получение марганцовка
- Физические свойства
- Калия Перманганат: инструкция по применению (Способ и дозировка)
- Химические свойства
- Как развести марганцовку для прижигания
- Цена Марганцовки. Где взять Перманганат калия?
- Химические свойства
- Получение
- Как применять марганцовку
- Марганцовка и растения
- Приготовление раствора
Народные рецепты с марганцовкой: мифы и реальность
В интернет-публикациях и видеоблогах садоводов-любителей нередко можно встретить советы по смешиванию перманганата калия со следующими веществами:
Как было сказано выше, марганцовка – очень серьёзный химический реагент, и его бездумное соединение с какими-либо веществами категорически недопустимо.
«Часто можно встретить совершенно фантастические рекомендации по смешиванию марганцовки с содой (см. → подкормка содой), борной кислотой и так далее. Все эти миксы абсолютно лишены смысла».
И. Русских, заместитель начальника инспекции по семеноводству главной государственной инспекции по карантину и защите растений Республики Беларусь.
К этому стоит добавить, что подобные смеси не просто бессмысленны, но и могут повысить фитотоксичность перманганата калия, навредив растениям.
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
- 2MnO2+3Cl2+8KOH⟶2KMnO4+6KCl+4H2O{\displaystyle {\ce {2MnO2 + 3Cl2 + 8KOH -> 2KMnO4 + 6KCl + 4H2O}}},
- 2K2MnO4+Cl2⟶2KMnO4+2KCl{\displaystyle {\ce {2K2MnO4 + Cl2 -> 2KMnO4 + 2KCl}}},
- 3K2MnO4+2H2O⟶2KMnO4+MnO2+4KOH{\displaystyle {\ce {3K2MnO4 + 2H2O -> 2KMnO4 + MnO2 + 4KOH}}},
- 2K2MnO4+2H2O⟶2KMnO4+H2↑+2KOH{\displaystyle {\ce {2K2MnO4 + 2H2O -> 2KMnO4 + H2 ^ + 2KOH}}}.
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Получение марганцовка
Раствор марганцовки
Получение марганцовки в промышленности связано с электролизом концентрированного раствора гидроксида калия с марганцевым анодом. В процессе электролиза материал анода постепенно растворяется с образованием знакомого всем фиолетового раствора, содержащего перманганат-ионы. На катоде происходит выделение водорода. Умеренно растворимый в воде перманганат калия (марганцовка) выделяется в виде осадка.
Было бы заманчиво вместо привычной марганцовки производить перманганат натрия, ведь гидроксид натрия доступнее, чем гидроксид калия. Однако в этих условиях выделить перманганат натрия NaMnO4 невозможно: в отличие от перманганата калия KMnO4, он прекрасно растворим в воде (при 20 °С его растворимость составляет 144 г на 100 г воды).
В нейтральной или слабощелочной среде марганцовка (перманганат) переходит в гидратированный оксид марганца:
2КМnО4+Н2О+3K2SO3→ 2MnO2+3K2SO4+2КОН.
 Перманганата калия. Восстановление в щелочной (2), нейтральной (3), кислой (4) среде
Перманганата калия. Восстановление в щелочной (2), нейтральной (3), кислой (4) среде
В нейтральной или слабощелочной среде перманганат-ион (марганцовка) восстанавливается до оксида марганца (IV):
MnО4+2Н2О+3е → MnО2+4ОН-. Особенно ярко марганцовка проявляет окисляющую способность в кислой среде:
MnО-4+8Н++5е → Mn2++4Н2О.
Подкисленный крепкий раствор перманганата буквально сжигает многие органические соединения, превращая их в углекислый газ и воду. Этим иногда пользуются химики для мытья лабораторной посуды, сильно загрязнённой плохо смываемыми остатками органических веществ.
Твёрдый перманганат калия и его крепкие растворы могут быть опасны. При отравлении концентрированным раствором марганцовки возникает ожог рта, пищевода и желудка. Если вдруг Вы глотнули такой раствор, надо немедленно промыть желудок теплой водой с добавлением активированного угля. Для этого можно также использовать раствор, содержащий в двух литрах воды полстакана слабого раствора (H2O2) и один стакан столового уксуса. В этом случае ионы марганца переходят в менее опасные катионы марганца, а сама химическая реакция протекает следующим образом:
2KMn04+5H2O2+6CH3COOH→ 2Mn(CH3COO)2+5O2+2CH3COOK+8H2O
Физические свойства
Внешний вид: тёмно-фиолетовые кристаллы с металлическим блеском. Показатель преломления составляет 1,59 (при 20 °C).
Растворяется в воде (см. таблицу), жидком аммиаке, ацетоне (2:100), метаноле, пиридине.
| Температура, °C | 10 | 20 | 25 | 30 | 40 | 50 | 65 |
|---|---|---|---|---|---|---|---|
| Растворимость, г/100 г воды | 4,22 | 6,36 | 7,63 | 9 | 12,5 | 16,8 | 25 |
Термодинамические свойства
| Стандартная энтальпия образования ΔH | −813,4 кДж/моль (т) (при 298 К) |
|---|---|
| Стандартная энергия Гиббса образования G | −713,8 кДж/моль (т) (при 298 К) |
| Стандартная энтропия S | 171,71 Дж/(моль·K) (т) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 119,2 Дж/(моль·K) (т) (при 298 К) |
Калия Перманганат: инструкция по применению (Способ и дозировка)
Согласно инструкции по применению, средство применяется наружно, в виде водных растворов различной концентрации:
- 0,02-1%-ный — для промывания желудка при отравлении, спринцеваний и подмывания;
- 0,01-1%-ный — для полоскания горла и ротовой полости;
- 0,1-05%-ный раствор — для обработки ран;
- 2-5%-ный — для смазывания ожоговых и язвенных поверхностей.
Применение концентрированных растворов Марганцовки
Пятипроцентный раствор марганцовокислого калия считается особенно концентрированным, поэтому он не может ни при каких обстоятельствах использоваться для внутреннего потребления и обработки слизистых: средство применяется только в крайних случаях и только наружно.
Некоторые специалисты рекомендуют использовать его для лечения грибковой инфекции кожи и онихомикозов, однако большинство микологов предпочитают назначать специальные противогрибковые препараты, поскольку они, по их мнению, более безопасны и эффективны.
Бытует также мнение что 5%-ный раствор эффективен при укусах ядовитых насекомых (например, тарантулов или скорпионов) и ядовитых змей. В данном случае его используют для промывания пораженного места, однако подобная мера может расцениваться только как первая помощь пострадавшему, и не отменяет необходимости обращения к врачу и немедленной (если это необходимо) госпитализации.
В народной медицине примочки с концентрированным холодным (!) раствором марганцовки иногда используются для лечения термических ожогов. Считается также, что регулярная обработка опасных с точки зрения появления пролежней участков тела крепким раствором марганцовокислого калия, помогает предупредить дистрофическое или язвенно-некротическое изменение тканей.
Безопасность и эффективность такого лечения, однако, следует в обязательном порядке обсуждать с лечащим врачом.
Пятипроцентный раствор используется и для лечения генерализованных поражений кожи, например, пиодермии.
Ванна от прыщей с марганцовокислым калием способствует ускорению подсыхания элементов сыпи и отпадению корочек. Процедуру повторяют ежедневно до исчезновения проявлений заболевания. Продолжительность воздействия — не более 15 минут. После ванной рекомендуется ополоснуть кожу прохладной водой.
Концентрированный раствор можно использовать от прыщей на спине, а также для прижигания мозолей и бородавок. Средство в указанных случаях наносят точечно.
Как развести Марганцовку при ветрянке?
При ветрянке перманганат калия разводят таким образом, чтобы получился не слишком концентрированный раствор. Это значит, что жидкость должна быть светло-розового цвета.
Правила разведения следующие: вначале несколько крупинок марганцовки растворяют примерно в 500 мл теплой воды, а затем полученный раствор переливают в другую емкость и доводят объем воды до нужного.
Сменным в растворе ватным тампоном протирают места высыпаний. Когда высыпания сойдут, для ускорения процесса подсыхания корочек можно принимать ванны с неконцентрированным раствором марганцовокислого калия.
Как сделать 5% раствор Марганцовки?
Для приготовления 5%-ного раствора 5 граммов препарата растворяют в 100 мл воды. Чтобы не ошибиться с дозировкой, необходимо пользоваться кухонными весами.
Если весов нет, в расчетах нужного количества перманганата калия отталкиваются от того, что в 1 ч. ложке его вмещается 6 граммов. Таким образом, для получения 5%-ного раствора, следует добавить это количество марганцовки к 120 мл воды.
Если в аптеке был куплен 3-х граммовый флакон с марганцовкой, для получения раствора нужной концентрации перманганат калия следует соединить с 60 мл воды.
Когда все кристаллы растворятся в воде, готовый раствор процеживают сквозь сложенную в несколько слоев марлю.
Как разводить для купания новорожденного Марганцовку?
Поскольку кожа младенцев очень нежная и чувствительная, для купания должен использоваться светло-розовый, не концентрированный раствор для купания.
Рекомендации относительно того, как сделать слабый раствор марганцовки следующие: в прозрачную стеклянную посуду наливают теплой воды и добавляют небольшое (на кончике ножа) количество перманганата калия.
Убедившись, что все кристаллики растворились, раствор переливают в другую емкость и доливают воду до нужного объема.
Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E, В |
|---|---|---|---|
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |
Слева направо (водные растворы): Co(NO3)2 (красный); K2Cr2O7 (оранжевый); K2CrO4 (жёлтый); NiCl2 (бирюзовый); CuSO4 (голубой); KMnO4 (фиолетовый)
Раствор KMnO4 в воде в мерной колбе
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
в кислой среде:
- 2KMnO4+5K2SO3+3H2SO4⟶6K2SO4+2MnSO4+3H2O{\displaystyle {\ce {2KMnO4 + 5K2SO3 + 3H2SO4 -> 6K2SO4 + 2MnSO4 + 3H2O}}};
в нейтральной среде:
- 2KMnO4+3K2SO3+H2O⟶3K2SO4+2MnO2+2KOH{\displaystyle {\ce {2KMnO4 + 3K2SO3 + H2O -> 3K2SO4 + 2MnO2 + 2KOH}}};
в щелочной среде:
- 2KMnO4+K2SO3+2KOH⟶K2SO4+2K2MnO4+H2O{\displaystyle {\ce {2KMnO4 + K2SO3 + 2KOH -> K2SO4 + 2K2MnO4 + H2O}}}.
Однако последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
- 2KMnO4+H2SO4⟶K2SO4+Mn2O7+H2O{\displaystyle {\ce {2KMnO4 + H2SO4 -> K2SO4 + Mn2O7 + H2O}}}.
При этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4{\displaystyle {\ce {MnO3HSO4}}}. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
- KMnO4+IF5⟶KF+IOF3+MnO3F{\displaystyle {\ce {KMnO4 + IF5 -> KF + IOF3 + MnO3F}}}.
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
- 2KMnO4→∘tK2MnO4 +MnO2 +O2{\displaystyle {\ce {2KMnO4->K2MnO4\ +MnO2\ +O2}}}.
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
- 5KMnO4→∘tK2MnO4 +K3MnO4 +3MnO2 +3O2{\displaystyle {\ce {5KMnO4->K2MnO4\ +K3MnO4\ +3MnO2\ +3O2}}}.
Реагирует с солями двухвалентного марганца, например:
- 2KMnO4+3MnSO4+2H2O⟶5MnO2+K2SO4+2H2SO4{\displaystyle {\ce {2KMnO4 + 3MnSO4 + 2H2O -> 5MnO2 + K2SO4 + 2H2SO4}}}.
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4{\displaystyle {\ce {K2MnO4}}} на MnO2{\displaystyle {\ce {MnO2}}} и KMnO4{\displaystyle {\ce {KMnO4}}}.
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
- 2KMnO4+3H2O2⟶2MnO2+3O2↑+2H2O+2KOH{\displaystyle {\ce {2KMnO4 +3H2O2 -> 2MnO2 + 3O2 ^ + 2H2O + 2KOH}}}.
Перманганат калия реагирует с концентрированной соляной, бромоводородной или иодоводородной кислотой. В результате выделяются свободные галогены:
- 2KMnO4+16HCl⟶2KCl+2MnCl2+5Cl2↑+8H2O{\displaystyle {\ce {2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 ^ + 8H2O}}}
Во время химической реакции хлорид-анион Cl−{\displaystyle {\ce {Cl^{-}}}} окисляется до элементарного хлора, а ион Mn7+{\displaystyle {\ce {Mn^{7+}}}} в перманганат-анионе восстанавливается до катиона Mn2+{\displaystyle {\ce {Mn^{2+}}}}:
- 2Cl−⟶Cl2↑{\displaystyle {\ce {2Cl^{-}-> Cl2 ^}}}
- Mn7+⟶Mn2+{\displaystyle {\ce {Mn^{7+}-> Mn^{2+}}}}
Как развести марганцовку для прижигания
Темные кристаллы перманганата калия до сих пор присутствуют во многих аптечках, несмотря на то, что продажа этого средства давно прекращена.
Аптека предлагает огромный выбор других самых разных медикаментов на все случаи жизни. Однако, порошок и водный раствор марганцовки для обработки ран всё также пригоден для использования.
В каких случаях можно применять марганцовку
Кристаллы перманганата калия или марганцовки (KMnO4) представляют собой калиевую соль марганцевой кислоты. Порошок тёмно бордового, почти чёрного цвета, хорошо растворим в воде, является сильным окислителем. При контакте с живыми клетками кожи в растворе или чистом виде выделяется атомарный кислород, благодаря этому проявляются антисептические свойства препарата.
Показания:
- Порошок, растворенный в воде, используется для промывки инфицированных ран – 0,1%-0,5%;
- Для обработки поверхностей язв, ожогов – 2-5%;
- Для полоскания рта, горла при инфекциях и воспалениях в носо- и ротоглотке: фарингитах, тонзиллитах, синуситах – 0,01-0,1%;
- Марганцовокислый калий нашел свое применение в лечении женских воспалительных болезней, раствор используется для спринцевания или же промывания при кольпитах, вагинитах, уретритах – 0,02-0,1%;
- В терапии слабо малиновым раствором промывают желудок при отравлении алкалоидами, фосфором, синильной кислотой;
- Для обработки поверхности кожи при попадании анилина;
- Жидкость слабой концентрации применяют для промывания слизистой оболочки глаз при укусе ядовитых насекомых.
Марганцовку нельзя использовать при гиперчувствительности к калию и магнию.
При передозировке возникает боль в полости рта, отек слизистой пищевода, глотки, боль в животе, рвота, понос, возможен ожоговый шок. Чтобы лечение препаратом не привело к печальным последствиям, не стало причиной развития осложнений, порошок нужно правильно разводить марганцовку для обработки раны и не допускать превышения дозировки.
Как правильно развести марганцовку для обработки ран
Для растворения кристаллов соли лучше пользоваться теплой водой, так порошок быстрее растворится. Для разведения воду следует прокипятить, затем остудить примерно до 40 О С. На 1 л жидкости нужно взять щепотку марганцовки.
Чтобы правильно приготовить раствор марганцовки для обработки ран вам необходимо знать:
- Нельзя брать вещество голыми руками, при этом можно получить сильный ожог кожи. Для этой цели используют ложку, нож, либо плоскую деревянную палочку;
- Готовый раствор должен быть светлым малинового оттенка. Если в результате получилась более темная концентрация, то для обработки ран раствор марганцовки необходимо разбавить водой до получения нужного оттенка;
- Нерастворенные частицы оседают на дне емкости, нужно немного подождать, чтобы они растворились либо жидкость необходимо процедить через несколько слоев марли или мелкое сито;
- Готовое средство нужно использовать сразу после приготовления, так как оно не подлежит хранению, оставшийся препарат выливают.
В хирургической практике жидкость используется для обработки ран, а также раствором отмачивают присохшие бинты, чтобы сделать перевязку.
Для промывания желудка не обязательно использовать зонд, пациент просто выпивает 0,5-1,5л светло розовой жидкости, после этого рвота вызывается рефлексом при надавливании на корень языка. При отравлениях алкоголем, морфином, лекарственными препаратами, когда рвоту нужно вызвать немедленно, пациентам также дают выпить марганцовку.
Правильное использование раствора
В быту марганцовку используют для снятия болевых ощущений при мозолях, для этого делают ножные ванны. В тазик с водой также добавляют в столовую ложку поваренной соли или пищевой соды. Ноги опускают в таз на 15 минут, через некоторое время мозоли перестают болеть.
Для профилактики опрелостей грудных детей купают в слабом бледно розовом растворе марганцовки.
Гигиенические ванны оказывают и лечебный эффект при долго незаживающей пупочной ранке, при стафилококковых и стрептококковых поражениях кожи.
Более насыщенным раствором можно обработать пупочную рану после купания.
Светло малиновой жидкостью можно вылечить потливость ног, устранить их неприятный запах. Тёплая ванна для ног с морской солью делается ежедневно по 20 минут до устранения неприятных симптомов. После этого ноги хорошо вытирают, особенно между пальцами, посыпают тальком либо используют пасту Теймурова.
При воспалительных поражениях гортани, при болезнях десен используют слабо концентрированный раствор для орошения ротовой полости, больной очаг нужно полоскать 4 раза в день по 5 минут.
Цена Марганцовки. Где взять Перманганат калия?
Приобрести Перманганат калия непросто. В интернете много как сообщений о том, что марганцовка запрещена и найти ее очень проблематично.
На вопрос, почему запретили продажу этого средства, некоторые фармацевты отвечают, что соответствующими приказами марганцовку приравняли к взрывчатым веществам, и продавать ее без лицензии нельзя.
Другие же говорят, что марганцовокислый калий отнесен к наркотическим веществам и, опять-таки, его продажа без соответствующей лицензии невозможна.
В советах относительно того, где купить марганцовку в аптеке Москвы, обычно указывают специализированные аптеки при родильных отделениях и детских поликлиниках, а также ветеринарные аптеки.
Перманганат калия купить в Москве можно также в хозяйственных магазинах и магазинах, которые реализуют товары для садоводства.
Аналогичные рекомендации дают в ответ на вопрос, где можно купить марганцовокислый калий в СПб или Киеве.
Сколько стоит в аптеке Марганцовка? Цена средства варьируется в пределах от 11 до 165 руб. (в зависимости от объема упаковки и формы выпуска).
Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Химические свойства
| Окисленная форма | Восстановленная форма | Среда | E, В |
|---|---|---|---|
| MnO4− | MnO42− | OH− | +0,56 |
| MnO4− | H2MnO4 | H+ | +1,22 |
| MnO4− | MnO2 | H+ | +1,69 |
| MnO4− | MnO2 | OH− | +0,60 |
| MnO4− | Mn2+ | H+ | +1,51 |

Слева направо (водные растворы): Co(NO3)2 (красный); K2Cr2O7 (оранжевый); K2CrO4 (жёлтый); NiCl2 (бирюзовый); CuSO4 (голубой); KMnO4 (фиолетовый)
Раствор KMnO4 в воде в мерной колбе
Является сильным окислителем. В зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде — до соединений марганца(II), в нейтральной — до соединений марганца(IV), в сильно щелочной — до соединений марганца(VI). Примеры реакций приведены ниже (на примере взаимодействия с сульфитом калия):
в кислой среде:
- 2KMnO4+5K2SO3+3H2SO4⟶6K2SO4+2MnSO4+3H2O{\displaystyle {\ce {2KMnO4 + 5K2SO3 + 3H2SO4 -> 6K2SO4 + 2MnSO4 + 3H2O}}};
в нейтральной среде:
- 2KMnO4+3K2SO3+H2O⟶3K2SO4+2MnO2+2KOH{\displaystyle {\ce {2KMnO4 + 3K2SO3 + H2O -> 3K2SO4 + 2MnO2 + 2KOH}}};
в щелочной среде:
- 2KMnO4+K2SO3+2KOH⟶K2SO4+2K2MnO4+H2O{\displaystyle {\ce {2KMnO4 + K2SO3 + 2KOH -> K2SO4 + 2K2MnO4 + H2O}}}.
Однако последняя реакция (в щелочной среде) идёт по указанной схеме только при недостатке восстановителя и высокой концентрации щёлочи, которая обеспечивает замедление гидролиза манганата калия.
При соприкосновении с концентрированной серной кислотой перманганат калия взрывается, однако при аккуратном соединении с холодной кислотой реагирует с образованием неустойчивого оксида марганца(VII):
- 2KMnO4+H2SO4⟶K2SO4+Mn2O7+H2O{\displaystyle {\ce {2KMnO4 + H2SO4 -> K2SO4 + Mn2O7 + H2O}}}.
При этом в качестве промежуточного продукта может образовываться интересное соединение — оксосульфат марганца MnO3HSO4{\displaystyle {\ce {MnO3HSO4}}}. По реакции с фторидом иода(V) можно получить аналогичный оксофторид:
- KMnO4+IF5⟶KF+IOF3+MnO3F{\displaystyle {\ce {KMnO4 + IF5 -> KF + IOF3 + MnO3F}}}.
При нагревании разлагается с выделением кислорода (этим способом пользуются в лаборатории для получения чистого кислорода). Схему реакции упрощённо можно представить уравнением:
- 2KMnO4→∘tK2MnO4 +MnO2 +O2{\displaystyle {\ce {2KMnO4->K2MnO4\ +MnO2\ +O2}}}.
На самом деле реакция идёт намного сложнее, например, при не очень сильном нагревании её можно примерно описать уравнением:
- 5KMnO4→∘tK2MnO4 +K3MnO4 +3MnO2 +3O2{\displaystyle {\ce {5KMnO4->K2MnO4\ +K3MnO4\ +3MnO2\ +3O2}}}.
Реагирует с солями двухвалентного марганца, например:
- 2KMnO4+3MnSO4+2H2O⟶5MnO2+K2SO4+2H2SO4{\displaystyle {\ce {2KMnO4 + 3MnSO4 + 2H2O -> 5MnO2 + K2SO4 + 2H2SO4}}}.
Эта реакция в принципе обратна дисмутации (диспропорционирование) K2MnO4{\displaystyle {\ce {K2MnO4}}} на MnO2{\displaystyle {\ce {MnO2}}} и KMnO4{\displaystyle {\ce {KMnO4}}}.
Окисляет органические вещества. В частности, разбавленные растворы перманганата калия в щелочной и нейтральной среде окисляют алкены до диолов (реакция Вагнера):
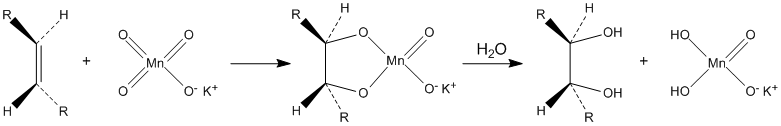
Водные растворы перманганата калия термодинамически нестабильны, но кинетически довольно устойчивы. Их сохранность резко повышается при хранении в темноте.
При смеси с пероксидом водорода протекает следующая реакция:
- 2KMnO4+3H2O2⟶2MnO2+3O2↑+2H2O+2KOH{\displaystyle {\ce {2KMnO4 +3H2O2 -> 2MnO2 + 3O2 ^ + 2H2O + 2KOH}}}.
Перманганат калия реагирует с концентрированной соляной, бромоводородной или иодоводородной кислотой. В результате выделяются свободные галогены:
- 2KMnO4+16HCl⟶2KCl+2MnCl2+5Cl2↑+8H2O{\displaystyle {\ce {2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 5Cl2 ^ + 8H2O}}}
Во время химической реакции хлорид-анион Cl−{\displaystyle {\ce {Cl^{-}}}} окисляется до элементарного хлора, а ион Mn7+{\displaystyle {\ce {Mn^{7+}}}} в перманганат-анионе восстанавливается до катиона Mn2+{\displaystyle {\ce {Mn^{2+}}}}:
- 2Cl−⟶Cl2↑{\displaystyle {\ce {2Cl^{-}-> Cl2 ^}}}
- Mn7+⟶Mn2+{\displaystyle {\ce {Mn^{7+}-> Mn^{2+}}}}
Получение
Химическое или электрохимическое окисление соединений марганца, диспропорционирование манганата калия. Например:
- 2MnO2+3Cl2+8KOH⟶2KMnO4+6KCl+4H2O{\displaystyle {\ce {2MnO2 + 3Cl2 + 8KOH -> 2KMnO4 + 6KCl + 4H2O}}},
- 2K2MnO4+Cl2⟶2KMnO4+2KCl{\displaystyle {\ce {2K2MnO4 + Cl2 -> 2KMnO4 + 2KCl}}},
- 3K2MnO4+2H2O⟶2KMnO4+MnO2+4KOH{\displaystyle {\ce {3K2MnO4 + 2H2O -> 2KMnO4 + MnO2 + 4KOH}}},
- 2K2MnO4+2H2O⟶2KMnO4+H2↑+2KOH{\displaystyle {\ce {2K2MnO4 + 2H2O -> 2KMnO4 + H2 ^ + 2KOH}}}.
Последняя реакция происходит при электролизе концентрированного раствора манганата калия и эндотермична, она является основным промышленным способом получения перманганата калия.
Как применять марганцовку
Обеззараживание посадочного материала
Семена цветов и овощей перед посевом желательно обеззаразить, чтобы впоследствии на сеянцах не развивались грибковые, вирусные и бактериальные болезни. Для обработки посевного материала готовят концентрированный раствор марганцовки (0,5 г кристаллов на 100 мл воды) и погружают в него семена на 20-30 минут, после чего минуту-другую промывают их под струей воды и затем дают семенам высохнуть до сыпучести. Точно так же обрабатывают цветочные и овощные клубни, луковицы и корнеплоды, предназначенные для получения черенков, чубуков, семян и другого посадочного материала.
Стерилизация посуды и садового инвентаря
Для обработки тары перед посадкой в нее растений или посева семян тоже используют концентрированный раствор: деревянные емкости выдерживают в нем в течение нескольких часов, а керамическую и пластиковую посуду достаточно просто обмыть в составе бордового цвета, а затем позволить высохнуть естественным образом. Садовый инвентарь протирают крепким раствором перманганата калия, а небольшие инструменты погружают в него на час. Проводят обработку перед каждым использованием и в конце дачного сезона. Смывать марганцовку не нужно, но желательно насухо вытереть металлические детали и части, чтобы они не покрылись ржавчиной, а в конце сезона после обработки нужно смазать металл техническим маслом.
Дезинфекция почвы
Марганцовка прекрасно дезинфицирует субстрат, предназначенный для выращивания рассады: в подогретую до 70 ºC воду добавляют такое количество порошка, чтобы раствор получился ярко-розового цвета. Этим раствором обильно опрыскивают уложенный в контейнер или ящик субстрат, а когда он остынет и чуть подсохнет, производят посев семян.
Обработка почвогрунта защитит рассаду от такого опасного заболевания, как черная ножка.
Почву в открытом грунте и в теплице перед посевом или высадкой рассады обрабатывают подобным образом, то есть ранней весной ярко-розовым раствором проливают грядки, клумбы, междурядья и приствольные круги деревьев. Раствор высокой температуры уничтожает не только возбудителей грибковой инфекции, но и зимующих в верхнем слое почвы вредителей.
Марганцовка как удобрение
Препарат содержит марганец, недостаток которого снижает иммунитет и, как следствие, урожайность растений. Если вы заметили желтую или кремовую пятнистость на молодых листьях, цвет жилок которых остается зеленым, скорее всего, это признак марганцевого голода. Следует знать, что кислые почвы обычно перенасыщены этим элементом, а в грунтах щелочной и нейтральной реакции марганец содержится в форме, которая недоступна для растений. Именно поэтому в такие почвы нужно 2-3 раза за сезон с интервалом в 2-3 недели вносить марганец в виде бледно-розового раствора. Осуществлять подкормку можно как под корень, так и по листьям.
Дезинфекция погреба и теплицы
Для обработки стеллажей, стен, каркасов и полок в теплицах и овощехранилищах готовят концентрированный раствор перманганата калия. В теплицах моют все горизонтальные и вертикальные поверхности ранней весной, перед началом сезона вегетации, а в погребах – перед закладкой урожая на хранение. Съемные полки и перекладины лучше на несколько часов замочить в растворе, а после этого высушить на солнце.
Марганцовка и растения
От ста вредителей
В пособиях садоводам-огородникам про марганцовку так и сказано: «Микроудобрение, содержащее марганец, предназначено для замачивания семян с целью обеззараживания и снижения заболеваемости растений, вызванных инфекциями и недостатком марганца-хлороза на нейтральных, щелочных и сильно известковых почвах. К растениям, особенно страдающим из-за недостатка марганца, относятся свекла, картофель, огурцы, капуста, фасоль, персик, вишня, слива, абрикос, яблоня и малина».
Наибольшую популярность марганцовка получила при обработке семян помидоров. В течение 20 минут семена замачивают в 0,5 % растворе марганцовки (0,5 г на 100 мл воды), затем тщательно промывают водой и просушивают.
Таким же способом обрабатывают лук-севок, семена капусты, редиса и многих однолетних и многолетних цветов. Кстати, использование марганцовки часто позволяет обойтись без фунгицидов.
ВНИМАНИЕ
В результате обработки семена окрашиваются в буровато-черный цвет. Поэтому пугаться и считать, что это ожоги, не нужно
Марганцовкой можно продезинфицировать почву на грядках, в ящиках или стаканчиках, приспособленных под выращивание растений. Так, рассаду в стаканчиках поливают теплым розовым раствором марганцовки каждые 10 дней. (Можно чередовать с поливом зольным щелоком.)
Перед тем как посадить семена любых овощей или цветов, землю в ящике поливают специальным раствором: 3–5 г марганцовки на 10 л воды. Это предотвращает заболевание «школки» помидоров, баклажана, перца, капусты «черной ножкой».
Такая же концентрация раствора понадобится и для обеззараживания почвы в теплице. 1 л раствора вливают в лунки для рассады помидоров, огурцов или других овощей. Впрочем, если быть внимательным к своим зеленым «подопечным», то по их внешнему виду почти всегда можно определить — здорово ли растение, а заприметив первые признаки инфекции, тут же принять необходимые меры. Однако для профилактики болезней и появления вредителей в теплице огородники «со стажем» несколько раз за сезон обрабатывают теплицу снаружи 0,5 % раствором марганцовки. Причем обрабатывают не только стены теплицы, но и территорию у входа. Внепланово (а значит, обязательно) огородники это делают при похолодании после дождя.
Подкормка раствором марганцовки (3 г на 10 л во¬ды) повышает сопротивляемость растений не только болезням, но и неблагоприятной погоде.
ПРИМЕЧАНИЕ
На суглинистых и торфяных почвах марганец способствует усвоению азота из почвы и помогает извлечению углекислого газа из воздуха. Таким образом, если обработать клубни картофеля марганцовкой, они станут более устойчивыми к парше, а у зимних сортов увеличится лежкость корнеплодов.
Рассмотрим влияние марганцовки на выращивание некоторых растений в отдельности. А поскольку речь завели о картофеле, продолжим эту тему и дальше.
Картофель
Сев. Почти все дачники-огородники, готовя картофель к посадке и радея о большем количестве посадочного материала, режут клубни на доли с «глазками». При этом опытные хозяева не забывают обрабатывать срезы специальным средством. Это нужно для того, чтобы картофель «не подхватил» всевозможных болезней. Срезы обеззараживают элементарным способом: картофель режут ножом, смоченным в растворе марганцовки. Затем «раны» клубней слегка посыпают золой.
Необходимо помнить, что резаный картофель, особенно на тяжелых почвах, нередко заражается почвенной инфекцией.
Фитофтороз. Практически каждый год картофель поражает опасная болезнь — фитофтороз. Он проявляется крупными расплывчатыми пятнами на листьях. Чтобы избежать заболевания, клубни картофеля перед посадкой орошают специальным раствором: 10 г марганцовки и 2 г медного купороса на 10 л воды. Расходуют из расчета 200 мл раствора на 10 кг картофеля.
Приготовление раствора
Что нужно знать, чтобы правильно развести марганцовку для лечебных целей?
Необходимо запомнить, что для 1% раствора марганцовки понадобится 1 г кристаллов марганцовки и 100 г воды. Обыкновенная чайная ложка имеет объем 5 мл. Если насыпать в нее марганцовку и убрать ножом горку, получится 6 г кристаллов. Из этого количества марганцовки для приготовления 1% раствора понадобится 600 мл воды.
1% раствор марганцовки имеет практически черный окрас. Это очень крепкий раствор. Его не применяют для внутреннего потребления во избежание ожогов слизистой. 1% раствор используют для лечения грибковых заболеваний, бородавок, пролежней. Такой раствор оказывает подсушивающее и местно-раздражающее действие, значительно ускоряющие процессы кровообращения.
Для приготовления слабых растворов берут меньшее количество кристаллов марганцовки.
Для приготовления растворов нельзя использовать металлические ёмкости, иначе это химическое вещество вступит в контакт с металлом, что станет причиной потери некоторой части лекарственных свойств и, кроме этого оставит несмываемые следы на посуде. Стеклянные ёмкости лучше всего подходят для приготовления растворов из марганцовки.
Воду для приготовления раствора надо брать теплую кипяченую. В теплой воде растворение кристаллов происходит намного лучше. Проводить полоскания и промывания также гораздо комфортнее тёплым раствором.
Кристаллы марганцовки не следует брать руками, так как можно получить ожог и оставить на коже некрасивые плохо смываемые следы. Взять несколько кристалликов поможет спичка или кончик ножа.
Полученный раствор обязательно профильтруйте через марлю, сложенную в несколько слоев, чтобы нерастворившиеся кристаллики не попали на слизистые или кожу и не стали причиной ожога.
При приготовлении раствора сначала в ёмкость наливают необходимое количество воды, а затем добавляют сухие кристаллы марганцовки.
Раствор перманганата калия сохраняет лечебные свойства в течение нескольких часов после приготовления. Как только жидкость примет коричневую окраску использовать его не имеет смысла: все полезные свойства утеряны.
Крепкий раствор марганцовки при длительном применении может стать причиной ожогов кожи.
Хранить кристаллы марганцовки следует в тёмном, сухом месте в плотно закрытой упаковке или ёмкости.














